AG Böckmann - Emmert
Arbeitsgruppenprofil

Die überwiegend durch Drittmittel finanzierte Forschungsgruppe um Klinikdirektor Univ.-Prof. Dr. med. Steffen Emmert und Laborleiter Dr. rer. nat. Lars Böckmann bearbeitet grundlagenorientierte und translationale Fragestellungen im Bereich der Dermato-Onkologie und Plasmamedizin.
Aktuell laufende Forschungsprojekte
TiO2-Nanopartikel
TiO2-Nanopartikel
Untersuchungen zur Eindringtiefe und Toxizität von Titandioxid-Nanopartikeln in barrieregestörter Haut nach UV-Exposition
Projektbeschreibung
Ziel des Projekts ist, die Eindringtiefe und Toxizität von Titandioxid-Nanopartikeln (TiO2-NP) in barrieregestörter Haut nach UV-Exposition zu untersuchen. TiO2-NP sind häufig Bestandteil von Sonnenschutzmitteln und Kosmetika. Während die Barrierefunktion gesunder Haut das Eindringen der TiO2-NP in Hautschichten mit teilungsfähigen Zellen verhindert, ist unklar ob TiO2-NP bei einer vorliegenden Hautbarrierestörung wie z. B. der Neurodermitis (Atopische Dermatitis) oder Schuppenflechte (Psoriasis) in tiefere Hautschichten eindringen können und dort in Kombination mit UV-Strahlung Schäden in der DNA verursachen und damit das Risiko für Hautkrebs erhöhen können. Zur Klärung dieser Fragestellung wird in enger Zusammenarbeit mit Partnern der TU Clausthal ein breites Spektrum an Methoden verwendet, um die Eindringtiefe der TiO2-NPs zu bestimmen wie auch deren Auswirkung auf Zellen und Gewebe zu untersuchen.
Projektleitung und -Mitarbeiter
- Prof. Dr. Steffen Emmert (Projektleitung)
- Dr. Lars Böckmann (Projektleitung)
- Philipp-Kjell Ficht, M.Sc. (Wiss. Mitarbeiter)
- Anna Staffelt, M.Sc. (MTA)
Publikationen (Auswahl)
Laufzeit
2022 -
Förderung
Das Projekt wird durch die DFG mit 314.500 € gefördert.

PlasmACT
PlasmACT
Untersuchungen zur biologischen Sicherheit und Wirksamkeit einer innovativen Multijet-Plasmaquelle für die Behandlung von aktinischen Keratosen
Projektbeschreibung
Im Rahmen des europäischen Doktorandennetzwerks „PlasmACT – Plasmamedizin gegen Aktinische Keratose“ (HORIZON-MSCA-2022-DN-01-01) ist es das Ziel dieses Teilprojektes an Hautklinik der Universitätsmedizin Rostock die biologischen Sicherheit eines optimierten Multijet-Plasmageräts zur Behandlung von aktinischen Keratosen zu untersuchen. Neben einer grundlegenden Charakterisierung des Plasmas an Zellkulturen in vitro, werden In-vivo-Modelle zur Untersuchung der Sicherheit und Wirksamkeit sowie menschliche Hautgewebeproben von Patienten mit Aktinischen Keratose eingesetzt. Im Zusammenspiel mit akademischen und industriellen Projektpartnern aus Deutschland, Frankreich, Belgien und den Niederlanden soll ein umfassendes Sicherheitsprofil des Geräts erarbeitet werden, das die Grundlage für zukünftige klinische Anwendungen und die Entwicklung eines marktfähigen medizinischen Geräts bildet.
Mehr Informationen zu PlasmACT
Projektleitung und -Mitarbeiter
- Prof. Dr. Steffen Emmert (Projektleitung)
- Dr. Lars Böckmann (Projektleitung)
- Agnieszka Ossowska, M.Sc. (Projektmitarbeiterin)
Publikationen (Auswahl)
Laufzeit
2024 - 2027
Förderung
This project has received funding from the European Union’s Horizon Europe research and innovation programme
under grant agreement no.101118430.
DINPlas
DINPlas
Erarbeitung einer DIN-Norm zur Testung der Wirksamkeit und Sicherheit von Atmosphärendruck-Plasmaquellen für medizinische Anwendungen (DINPlas)
Projektbeschreibung
In diesem Verbundvorhaben soll gemeinsam mit Partnern vom INP Greifswald, akademischen Partner und Herstellern von Plasmageräten die Vorschriften der DIN SPEC 91315 „Allgemeine Anforderungen an medizinische Plasmaquellen“ überarbeitet und optimiert werden. Das Ziel unseres Teilprojektes an der Universitätsmedizin Rostock (UMR) liegt in der Anpassung geeigneter In-vitro-Testverfahren zur Bewertung von Zytotoxizität, Gewebeschädigungen, Gentoxizität verschiedener Plasmaquellenkonzepte gegenüber eukaryotischen Zellen. Dabei wird an die Vorschriften der DIN SPEC 91315 angeknüpft und diese durch weitere Testverfahren erweitert.
Projektleitung und -Mitarbeiter
- Prof. Dr. Steffen Emmert (Projektleitung)
- Dr. Lars Böckmann (Projektleitung)
- Thoralf Bernhardt (Wiss. Mitarbeiter)
Laufzeit
2020 –
Förderung
Das Projekt wird durch das Bundesministerium für Wirtschaft und Energie (BMWi) mit 235.100€ gefördert.

Synthetische Letalität
Synthetische Letalität
Ermittlung von synthetisch letalen Interaktionen für die Krebstherapie
Projektbeschreibung
Individualisierte und zielgerichtete Behandlungsstrategien unter Berücksichtigung molekularer Eigenschaften von Tumoren gewinnen zunehmend an Bedeutung in der Krebstherapie. Eine routinemäßige Etablierung von primären Zellkulturen aus Tumorgewebe und dazugehörigem gesunden Gewebe des selben Patienten würde eine individualisierte Therapietestung an diesem Material ermöglichen. Auch innovative Behandlungsstrategien wie das gezielte Ausnutzen von synthetisch letalen Interaktionen können auf diese Weise erforscht und getestet werden. Synthetische Letalität stellt einen effektiven, nebenwirkungsarmen und innovativen Therapieansatz dar, da sie unter Berücksichtigung molekularer Veränderungen in Tumorzellen die selektive Behandlung dieser Zellen ermöglicht. Zwei Gene befinden sich in einer synthetisch letalen Interaktion, wenn der Defekt eines dieser Gene toleriert wird, während der simultane Defekt beider Gene letal ist. So können Tumorzellen, die bereits einen Genedefekt aufweisen (Mutation oder differentielle Expression), gezielt durch Hemmung eines zweiten Gens (synthetisch letaler Interaktionspartner) eliminiert werden, während gesunde Zellen ohne diesen Gendefekt weitestgehend unbeschadet bleiben. Ziel dieses Forschungsvorhabens ist es zunächst am Beispiel des Plattenepithelkarzinoms Zellkulturpaare aus Tumorgewebe und gesundem Gewebe zu etablieren und zu Charakterisieren. Anschließend soll das Modell unter anderem zur Validierung von synthetisch letalen Interaktionen herangezogen werden.
Publikationen
Projektleitung und -Mitarbeiter
- Prof. Dr. Steffen Emmert (Projektleiter)
- Dr. Lars Böckmann (Projektleiter)
- Maximilian Ulrich (Projektmitarbeiter)
Laufzeit
2018 -
Förderung
Nachwuchsförderprogramm der Universitätsmedizin Rostock FORUN 2018 (Lars Böckmann), Forschungspreis/Stipendium der Dermatologischen Gesellschaft Mecklenburg-Vorpommern (Lars Böckmann)
XP Spleißvarianten
XP Spleißvarianten
Alternative Spleißvarianten von Xeroderma pigmentosum Genen: Funktionen und Bedeutung für Hautkrebsrisiko und -prognose
Projektbeschreibung
Die Nukleotid-Exzisions-Reparatur (NER) dient der Reparatur von vor allem „sperrigen“ DNA-Läsionen wie UV-induzierten Photoprodukten, die bei der Entwicklung von Hautkrebs beteiligt sind. Gendefekte der NER können verschiedene genetische Erkrankungen auslösen. Zu diesen zählen die seltene autosomal-rezessive Erkrankung Xeroderma pigmentosum (XP), das Cockayne-Syndrom (CS) und Trichothiodystrophie (TTD).
Die beiden Helikasen des TFIIH-Komplexes, XPB und XPD, sind für diesen Prozess sehr wichtig. Insbesondere XPB ist auch an der Transkription beteiligt. Eine Datenbankrecherche zeigt eindeutig, dass eine Reihe von putativen spontanen XPB und XPD Spleißvarianten existiert (ensembl, RefSeq).
Das Ziel des Projektes ist die Identifikation von alternativen Spleißvarianten und Funktionsevaluation von spontanen alternativen Spleißvarianten dieser beiden XP-Gene - auch im Hinblick auf den Metabolismus der Zelle. Zudem soll untersucht werden, ob Unterschiede in der Expressionshöhe von spontanen alternativen Spleißvarianten in verschiedenen Geweben bestehen und ob spontane alternative Spleißvarianten als Marker für das
Projektleitung und -Mitarbeiter
- Linda Laurer (Doktorandin)
Haut-ErdBEHR/Seneszenz
Haut-ErdBEHR/Seneszenz
Proof of Concept Studie zur Bestimmung zellulärer Seneszenz mittels Einzelzellsequenzierung nach Nahrungsmittelintervention oder topischer Behandlung mit Senolytika zur Hautkrebsprävention
Projektleitung und -Mitarbeiter
Prof. Dr. Steffen Emmert (Projektleitung)
Dr. Lars Böckmann (Projektleitung)
Lea Volkheimer (Doktorandin)
Förderung
Das Projekt wird durch das PUSH-Förderprogramm der UMR mit 20.000,00 € gefördert.
SYLOBIO
SYLOBIO-Teilprojekt R01
Charakterisierung kombinierter Wundauflagen hinsichtlich regenerativer sowie toxischer Eigenschaften in vitro und ex vivo
Projektbeschreibung
Im Rahmen des DFG Graduiertenkollegs SYLOBIO (GRK 2901) ist es Ziel des Teilprojektes der Dermatologie lokale (Un)verträglichkeiten metallfunktionalisierter Wundauflagen zu untersuchen. Während Wundauflagen Heilungsprozesse bei der Geweberegeneration unterstützen sollen, können die verwendeten Biomaterialien auch negative Einflüsse auf diese regenerativen Prozesse ausüben. Vor diesem Hintergrund sollen kombinierte Biomaterialien zur verbesserten Geweberegeneration charakterisiert werden. Silber oder Titandioxid enthaltende elektrogesponnene Nanofaservliese werden allein sowie in Kombination mit kaltem Atmosphärendruckplasma in vitro und ex vivo auf ihre zytotoxischen und regenerativen Eigenschaften untersucht werden.
Projektleitung und -Mitarbeiter
- Prof. Dr. Steffen Emmert (Teilprojektleiter, stellvertretender Sprecher)
- Dr. Lars Böckmann (Teilprojektleiter)
- Wieland Milz (Proketmitarbeiter)
Laufzeit
seit 2024
Förderung
DFG
Abgeschlossene Projekte
ONKOTHER-H
ONKOTHER-H
Entwicklungsplattform für innovative onkologische Therapien am Beispiel des häufigsten menschlichen Krebses – Hautkrebs
Projektbeschreibung
Im vom Klinikdirektor Prof. Dr. Steffen Emmert koordinierten und von Dr. Tobias Fischer gemanagten Verbundprojekt ONKOTHER-H arbeiten interdisziplinär und transinstitutionell sechs Projektpartner bestehend aus acht Arbeitsgruppen aus zwei Universitäten und einer außeruniversitären Forschungseinrichtung in Mecklenburg-Vorpommern zusammen (Tabelle 1). Ziel des Verbundes ist es, eine translationale Entwicklungsplattform für neue Krebstherapien zu etablieren. Dazu haben sich die homogenen Hautkrebsentitäten, als Modelle etabliert. Am Beispiel des kutanen Melanoms und des Plattenepithelkarzinoms der Haut werden neu synthetisierte und pharmakologisch relevante Moleküle (small molecules) und die innovative Behandlung mit kaltem Atmosphärendruckplasma sowie deren Kombination von der Zellkultur bis in die in vivo Situation hinein evaluiert.
Unser Teilprojekt (P1) „DNA Toxizität und Reparatur“ befasst sich mit der Toxizität, Mutagenität, dem Mutationsspektrum sowie der Bestimmung diverser DNA-Läsionen die möglicherweise durch die Behandlung mit den innovativen Therapieansätzen entstehen. Dazu werden zunächst geeignete Zellkulturmodelle für das Plattenepithelkarzinom sowie für das kutane Melanom verwendet und bereitgestellt. Anschließend werden die Ergebnisse in der in vivo Situation am Mausmodell validiert.
Publikationen (Auswahl)
Projektleitung und -Mitarbeiter
Prof. Dr. Steffen Emmert (Projektleitung)
Dr. Lars Böckmann (Projektleitung)
Dr. Tobias Fischer, M.A. (Projektkoordination)
Thoralf Bernhardt, M.Sc. (Wiss. Mitarbeiter)
Mirijam Schäfer, M.Sc. (Wiss. Mitarbeiterin)
Marie Luise Semmler, M.Sc. (Wiss. Mitarbeiterin)
Annika Glatzel, B.Sc. (Master-Studierende)
Laufzeit
2018 - 2022
Förderung
Das Verbundprojekt „ONKOTHER-H” wird durch den Europäischen Sozialfonds (ESF) mit dem Förderkennzeichen ESF/14-BM-A55-0001/18 und dem Ministerium für Bildung, Wissenschaft und Kultur des Landes Mecklenburg-Vorpommern mit 2,2 Mio. Euro gefördert.

SNAP29
SNAP29
Die Generierung sowie Charakterisierung eines CRISPR/Cas9-vermittelten Knockouts von SNAP29 in humanen Fibroblasten
Projektbeschreibung
Das autosomal rezessiv vererbte CEDNIK-Syndrom (engl. Cerebral Dysgenesis, Neuropathy, Ichthyosis, Palmoplantar Keratoderma) ist eine äußerst seltene Hauterkrankung und wurde erstmals 2005 durch Eli Sprecher und Kollegen beschrieben. Mutationen im SNAP29-Gen, welches für ein SNARE-Protein codiert und damit eine wichtige Rolle beim Andocken und bei der Fusion von Vesikelmembranen an die Zielmembran spielt, führen bei den Patienten zu einer abnormalen Entwicklung des Nervensystems und zu einer atypischen Differenzierung der Epidermis. Um die Rolle von SNAP29 an menschlichen Zellen weiter charakterisieren zu können, haben wir mittels der CRISPR/Cas9-Technologie eine humane SNAP29-Knockout Zelllinie generiert. Diese bildet nun eine wichtige Grundlage für eine umfassende Charakterisierung zur Analyse der Funktionen von SNAP29.
Publikationen
Martens MC, Edelkamp J, Seebode C, Schäfer M, Stählke S, Krohn S, Jung O, Murua Escobar H, Emmert S, Boeckmann L. Generation and characterization of a CRISPR/Cas9-mediated SNAP29 knockout in human fibroblasts. Int. J. Mol. Sci. 2021 May:(22)5293; IF 4,556
Projektleitung und -Mitarbeiter
- Prof. Dr. Steffen Emmert (Projektleitung)
- Dr. Lars Böckmann (Projektleitung)
- Dr. Christine Seebode (Projektleitung)
- Dr. Marie Christine Martens (Projektmitarbeiterin)
Laufzeit
2015 - 2020
Förderung
Nachwuchsförderprogramm der Universitätsmedizin Rostock FORUN 2015 // Stipendium der Deutschen Stiftung Dermatologie
Plasfect
Plasfect
Medizinische Gas Plasmatechnologie gegen Antibiotika-resistente Bakterien auf Wunden (Plasfect) - Evaluierung der Wirksamkeit in menschlichen chronischen Wunden
Projektbeschreibung
Das Ziel des Verbundprojekts „Plasfect“ ist die Bekämpfung von antibiotikaresistenten Bakterien (AMR) in Wunden mittels physikalischer Kaltplasma-Technologie. In einer deutsch-französischen Zusammenarbeit von Wissenschaftler*innen und Mediziner*innen aus vier Instituten werden innovative Studien von der physikalischen Entwicklung einer neuen Plasmaquelle, über Toxizitätsstudien im Zellkulturlabor und der Etablierung entsprechender Tierversuchsmodelle, bis hin zur Untersuchung von keimbelasteten Wunden von Patienten durchgeführt.
Projektleitung und -Mitarbeiter
- Prof. Dr. Steffen Emmert (Projektleitung)
- Dr. Lars Böckmann (Projektleitung)
- Dr. Paulina Troitsch (Ärztl. Mitarbeiter)
- Anika Beck (Ärztl. Mitarbeiterin)
Laufzeit
2021 - 2024
Förderung
Das Projekt wird durch das Bundesministerium für Bildung und Forschung (BMBF) mit 193.720€ gefördert.

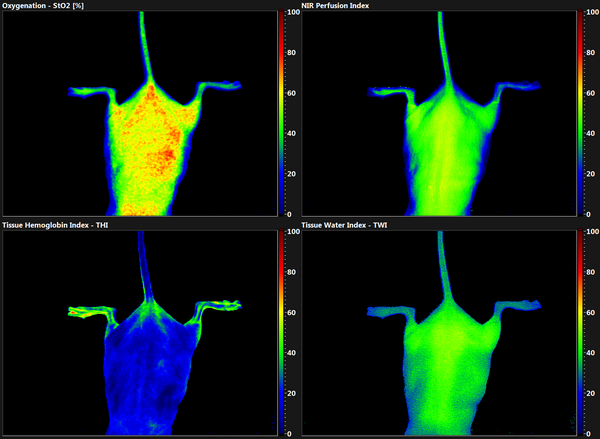
Radiodermatitis
Radiodermatitis
Innovative Therapie und Verlaufsdiagnostik der Radiodermatitis
Projektbeschreibung
Dieses translationale Forschungsvorhaben untersucht die klinische und molekulare Wirkung von kaltem Atmosphärendruckplasma (KAP) zur abmildernden Behandlung von Strahlenreaktionen der Haut (Radiodermatitis). Ein erhebliche Anzahl Patienten, die sich im Rahmen einer Krebsbehandlung einer Strahlentherapie unterziehen müssen, entwickeln als Folge der Bestrahlung eine Strahlendermatitis. Diese äußert sich durch das Auftreten von Erythemen, Ödemen, feuchten Desquamationen und Ulzerationen sowie Haarverlust. Diese Symptome werden in der Regel von starken Schmerzen und Juckreiz begleitet, was zu einer Unterbrechung, oder – in schweren Fällen – gar zum Abbruch der Strahlentherapie führen kann. Um die zugrundeliegenden Pathomechanismen einer Strahlendermatitis sowie deren Modulation durch eine Behandlung mit KAP besser zu verstehen, wird am Mausmodell der Verlauf der Erkrankung mit und ohne Behandlung durch nichtinvasive, objektive bildgebender Verfahren dokumentiert und verglichen. Hautbiopsien werden für molekulare Analysen herangezogen. Ziel ist es die Nebenwirkungen einer Strahlentherapie mittels einer KAP-Behandlung zu reduzieren, um eine ununterbrochene Krebstherapie zu ermöglichen.
Publikationen (Auswahl)
Projektleitung und -Mitarbeiter
Prof. Dr. Steffen Emmert (Projektleitung)
Dr. Lars Böckmann (Projektleitung)
Thoralf Bernhardt, M.Sc. (Wiss. Mitarbeiter)
Laufzeit
2018 -
Förderung
Das Projekt wird durch die Damp Stiftung mit 99.000 Euro gefördert.